TERMODINÁMICA
La termodinámica es la rama de la física que estudia los procesos en los cuales un cuerpo intercambia energía con el medio que lo rodea.
EQUIVALENTE MECÁNICO DEL CALOR
Es la equivalencia en energía (trabajo) de cierta cantidad de calor. Se relaciona básicamente por:
1 caloría = 4,18 joules
También se enuncia como: Cuando se realiza un trabajo sobre un sistema cualquiera, dicho trabajo se emplea en aumentar la energía interna del cuerpo y por lo tanto su temperatura.

INTERCAMBIO DE ENERGÍA
En un sistema, el intercambio de energía se produce sólo de dos formas:
- Mediante el calor que se intercambia por diferencias de temperaturas.
- Mediante un trabajo cuando una fuerza realiza un desplazamiento o deformación de un cuerpo.
El primer caso es el mencionado en la sección de Calorimetria. El segundo caso es más propio del estudio de la termodinámica y posee un sentido más general de los procesos.
Ejemplo: Cuando un gas se encuentra contenido en un cilindro con émbolo, y éste es calentado por una llama, el gas absorbe un cierto calor Qya que la temperatura de la llama es mayor que la del gas. Debido a esto, el gas presiona al émbolo y origina un movimiento físico que se traduce como un trabajo W sobre algún cuerpo externo. La energía externa E del gas sufrió variaciones, a medida que ganaba energía de la llama para luego emplearla en el trabajo W.
En el anterior ejemplo, al igual que en todo proceso semejante, se cumple el Principio de la Conservación de la Energía, ya que la energía de la llama se transformó en el trabajo W.
LEY CERO DE LA TERMODINÁMICA
Si dos sistemas se encuentran en equilibrio térmico con un tercer sistema, entonces los dos sistemas se encuentran en equilibrio entre sí.
PRIMERA LEY DE LA TERMODINÁMICA
El aumento de energía interna (ΔE) de un cuerpo es igual al calor absorbido (Q) mas el trabajo realizado sobre el cuerpo por fuerzas externas (WEXT), es decir:
El primer principio de la termodinámica es una reafirmación del Principio de la Conservación de la Energía, que incluye al calor como otra forma de energía.
Dependiendo del caso, el sistema puede absorber o desprender calor Q y realizar, recibir o no realizar un trabajo W. En estos casos, se considera la siguiente convección de signos para la fórmula:
ΔE = Q + WEXT
- Cuando el cuerpo absorbe calor, Q es positivo. si desprende calor, Q es negativo.
- Cuando el cuerpo produce trabajo, W es negativo (WEXT = - W).
- Cuando el cuerpo recibe trabajo, W es positivo (WEXT = W).
- Cuando el cuerpo no produce trabajo, W es cero (WEXT = 0).
PROCESOS TERMODINÁMICOS

PROCESO
Conjunto de etapas de un determinado fenómeno físico.
Según las condiciones del sistema termodinámico, se pueden presentar diferentes casos:
PROCESO CÍCLICO
Ocurre cuando en un sistema, el estado final de los procesos es idéntico al estado inicial, es decir, la energía interna final del cuerpo es igual a la inicial (Ef = Eo). Por lo tanto, cuando un sistema describe un ciclo, el calor absorbido es igual al trabajo realizado por él mismo: Q = W → ΔE = Q
PROCESO ADIABÁTICO
Ocurre cuando el sistema no gana o pierde calor, es decir, que el calor Q = 0 y toda la energía interna del cuerpo se convierte en trabajo: ΔE = - W
PROCESO ISÓCORO
Ocurre cuando el sistema permanece con volumen constante, es decir, que no sufre desplazamiento y por lo tanto el trabajo: W = 0
PROCESO ISOBÁRICO
Ocurre cuando el sistema permanece con presión constante: Pf = Po
PROCESO ISOTÉRMICO
Ocurre cuando el sistema permanece con temperatura constante: Tf = To
Los mejores ejemplos de estos procesos, se encuentran en las leyes de los gases.
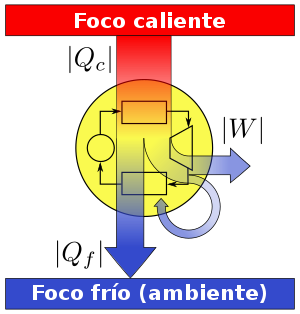
MÁQUINAS TÉRMICAS Y REFRIGERANTES
MÁQUINA TÉRMICA
Es todo sistema capaz de absorber calor de un cuerpo caliente para realizar un trabajo y ceder parte de ese calor a otro cuerpo frío, realizando este proceso de forma cíclica. Ejemplo: Motores de combustión interna, calderas de locomotoras, turbinas de vapor, etc. Usualmente, el propósito de estas máquinas es transformar la energía térmica en energía mecánica, para usarla en provecho de otros usos.
La eficiencia o rendimiento de una máquina térmica es la razón entre el trabajo mecánico realizado en el ciclo y el calor absorbido desde el cuerpo más caliente:
E = eficiencia o rendimiento
W = trabajo del calor absorbido durante el ciclo
Q1 = calor del cuerpo más caliente
Q2 = calor que cede al cuerpo más frío
MÁQUINA REFRIGERANTE
Es el sistema opuesto a una máquina térmica, ya que absorbe calor de un cuerpo frío y se lo entrega a un cuerpo más caliente de forma cíclica. Para realizar este trabajo se requiere de un gasto de energía externa sobre el sistema. Ejemplo: Neveras, congeladores, equipos de aire acondicionado.
SEGUNDA LEY DE LA TERMODINÁMICA
El calor absorbido de un cuerpo caliente no se puede transformar en trabajo, sin ceder una cantidad menor de calor a un cuerpo frío.
Este principio, se refiere a que NO se puede transformar total e íntegramente un calor Q en un trabajo W, ya que siempre habrá una pequeña pérdida de calor que se disipa en el sistema. Es decir, que por más perfecta que se intente construir una máquina (de cualquier tipo), siempre habrá una ligera pérdida de energía en la misma. Sin embargo, en la práctica, cuando dichas pérdidas de energía son insignificantes, al sistema se lo puede considerar cerrado e ideal para los cálculos y observaciones teóricas (como en los anteriores procesos termodinámicos).
Del enunciado de este principio, se extraen y deducen otros postulados importantes para el estudio de los procesos:
POSTULADOS CONSECUENCIA DEL SEGUNDO PRINCIPIO DE LA TERMODINÁMICA
I. Para transformar calor en trabajo, es necesario tener dos cuerpos a temperaturas diferentes.
II. Para transportar cierta cantidad de calor de un cuerpo frío a uno caliente, se requiere suministrar un trabajo externo. Por eso el calor sólo pasa espontáneamente de los cuerpos calientes a fríos.
III. El calor tiende a distribuirse de modo que todos los cuerpos queden a la misma temperatura, resultando que la energía calorífica se hace cada vez menos disponible para transformarse en trabajo.
Del segundo principio de la termodinámica, se deriva un concepto cuyo significado es de los más importantes de toda la ciencia:
ENTROPÍA
La entropía (S) es una medida del estado de desorden o agitación de las moléculas de un cuerpo. Cuanto mayor sea el desorden molecular, mayor es la entropía del cuerpo. Ejemplo: Una sustancia en estado sólido, cuyas moléculas están relativamente ordenadas, tiene menor entropía que en el estado gaseoso, cuando sus moléculas se encuentran muy desorganizadas.
Si un cuerpo absorbe calor Q mateniéndose a la temperatura T, experimenta un aumento de entropía (ΔS) dado por la expresión:
De este modo, el segundo principio de la termodinámica también se le puede mencionar como:
La entropía de un sistema aislado y cerrado NO PUEDE DISMINUIR y por lo tanto, sólo son posibles aquellos procesos en los que la entropía aumenta o permanece igual.
La entropía determina la dirección en que ocurren todos los procesos en la naturaleza, siempre teniendo al desorden de forma general. De ahí, que sea importante su estudio para toda la ciencia. Ejemplo: El calor pasa espontáneamente de los cuerpos calientes a los fríos, debido a que ese es el camino que incrementa la entropía del sistema en forma natural.
Se concluye además que: La esencia de ser de todas las cosas del Universo es tender siempre al caos y el desorden (destrucción). Sin embargo, mientras se desarrolla este proceso, transcurre cierto tiempo en el que se puede aprovechar las circunstancias para obtener algún beneficio nuestro, o para el surgimiento de nuevos eventos y procesos espontáneos en la naturaleza.
NOTA: Existe un tercer y último principio de la termodinámica, cuyo estudio es más avanzado y complejo. Su enunciado es: La entropía de todas las sustancias en el cero absoluto puede considerarse que es cero.



No hay comentarios.:
Publicar un comentario